ทำไงดี....เมื่อเพิ่มปริมาณดีเอ็นเอโดยตรงจาก FTA ไม่ได้
ไม่บ่อยนัก ที่ผมต้องเพิ่มปริมาณดีเอ็นเอจากตัวอย่างตรวจที่เป็นกระดาษ FTA ซึ่งโดยทั่วไป ก็ใช้วิธีการสกัดตามที่แนะนำไว้ในใบแทรกน้ำยาของบริษัท ซึ่งก็ไม่มีปัญหาแต่ประการใด
แล้วเมื่ออาทิตย์ที่ผ่านมา มีตัวอย่างสองตัวอย่าง เป็นตัวอย่างตรวจเซลล์เยื่อบุกระพุ้งแก้ม ส่งจากต่างประเทศ เพื่อนำมาตรวจรูปแบบดีเอ็นเอเปรียบเทียบกับศพฝรั่งคนหนึ่ง โดยอ้างว่าเป็นพ่อและแม่ของศพ ผมก็สกัดตามวิธีการปกติปรากฎว่า ตัวอย่างตรวจจากแม่ไม่มีปัญหาแต่ประการใด สามารถเพิ่มปริมาณดีเอ็นเอได้ตามปกติ แต่ตัวอย่างตรวจจากพ่อ ปรากฎว่าไม่สามารถเพิ่มปริมาณดีเอ็นเอได้ ดังภาพข้างล่างนี้ครับ
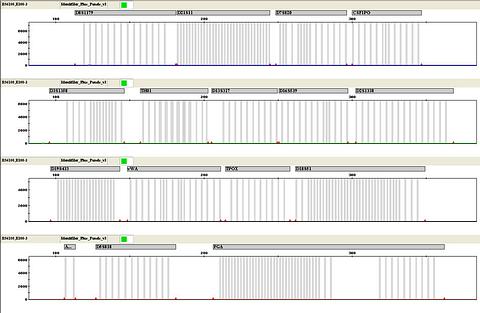
ผมก็เลยทำซ้ำอีกครั้ง ก็ยังไม่สามารถเพิ่มปริมาณดีเอ็นเอได้ ปัญหานี้ก็น่าจะมาจากตัวอย่างตรวจครับ เพราะตัวอย่างอื่นๆ ก็ยังสามารถทำการทดสอบเพิ่มปริมาณดีเอ็นเอได้ตามปกติ เกิดอะไรขึ้นกับตัวอย่างนี้.....
เราวิเคราะห์ปัญหานี้ว่า อาจเกิดได้จากสองสาเหตุใหญ่ๆ คือ
1. บนกระดาษ FTA ที่เราทดสอบนั้น หลังจากผ่านกระบวนการล้างแล้ว เหลือปริมาณดีเอ็นเออยู่บนกระดาษน้อยเกินไป ไม่ว่าจะด้วยสาเหตุใดก็ตาม เช่น FTA มีปัญหาการเสื่อมสภาพ ทำให้ดีเอ็นเอจับกับประจุบวกบนกระดาษไม่ได้ หรือได้ไม่ดี เมื่อล้างก็จะหลุดออกมาได้ง่าย หรือ ปัญหาจากตัวอย่างตรวจมีความเป็นด่างสูง ทำให้ประจุบวกบนกระดาษ FTA มีแนวโน้วจะเปลี่ยนเป็นประจุลบ ทำให้ดีเอ็นเอไม่สามารถจับกับกระดาษ FTA ได้ต่อไป จึงหลุดออกมาระหว่างขั้นตอนการล้าง หรือเหตุผลอื่นๆอีกสารพัด....
2. บนกระดาษ FTA มีปริมาณดีเอ็นเออยู่มากเพียงพอที่จะทำการทดสอบ แต่มีสารยับยั้งการเพิ่มปริมาณดีเอ็นเอ (PCR inhibitor) อยู่ด้วย จึงทำให้ไม่สามารถเพิ่มปริมาณดีเอ็นเอได้
แล้วจะเกิดจากสาเหตุไหน อย่างนี้ก็ต้องลองดูครับ
ผมก็เจาะ FTA ขนาดประมาณ 1.2 mm ตามปกติ แต่นำมา Fix ด้วย absolute ethanol นาน 5 นาที ก่อนที่จะนำไปล้างด้วย FTA reagent และ TE buffer ตามขั้นตอนการสกัดดีเอ็นเอจาก FTA ตามปกติที่ทดสอบ ผลปรากฎว่า ไม่สามารถเพิ่มปริมาณดีเอ็นเอได้ ดังภาพนี้ครับ

ผมอธิบายเรื่องนี้ว่า ดังนี้ครับ การที่นำ FTA มาแช่ใน absolute ethanol นาน 5 นาที ก่อนนำไปล้างตามขั้นตอนปกติ เป็นการ fix สารต่างๆ ให้ติดบนกระดาษ เพราะ absolute ethanol จะทำหน้าที่ดึงน้ำออกจากกระดาษ FTA ทำให้สารต่างๆ หรือแม้แต่เซลล์หากยังไม่แตกสลาย ก็จะยึดติดกับกระดาษ FTA ได้แน่นยิ่งขึ้น ทำให้เราแน่ใจได้มากยิ่งขึ้นว่า บนกระดาษ FTA จะมีดีเอ็นเอติดอยู่มากกว่าปกติ อย่างไรก็ตาม แม้ว่าจะมีดีเอ็นเอมากกว่าปกติแล้วก็ยังไม่สามารถเพิ่มปริมาณดีเอ็นเอได้ แสดงว่าปัญหานี้น่าจะมาจากสาเหตุที่สอง นั่นคือ มีสารยับยั้งการเพิ่มปริมาณดีเอ็นเอ ติดอยู่บนกระดาษ FTA ครับ ทำให้ไม่สามารถเพิ่มปริมาณดีเอ็นเอจากกระดาษ FTA ได้
แล้วจะแก้ปัญหานี้อย่างไร
ถ้าจะแก้ปัญหา ก็อยู่ที่เราจะแก้ที่ไหน ถ้าแก้ที่กระดาษ FTA ที่เจาะรูแล้ว ทำการล้างแล้ว แต่ยังติด PCR inhibitor อยู่ ....น่าจะเป็นขั้นตอนที่แก้ไขได้ค่อนข้างยากกว่า การที่เรามาเล่นกับดีเอ็นเอในส่วนที่ไม่อยู่บนกระดาษ
ปกติแล้ว เมื่อเอาเซลล์ไปป้ายบนกระดาษ FTA บนกระดาษจะมีสาร SDS ผสมอยู่ในเนื้อกระดาษ สารนี้มีหน้าที่ทำให้เซลล์แตก แล้วปลดปล่อยดีเอ็นเอออกมา ดีเอ็นเอซึ่งมีประจุเป็นลบ จะเข้ามาจับกับ Silanol group ที่ถูกปรับสภาพให้มีประจุเป็นบวก ทำให้ดีเอ็นเอจับติดแน่นอยู่บนกระดาษ ขึ้นตอนการล้างด้วย FTA reagent เป็นการกำจัดสารต่างๆ ทีติดมากับตัวอย่างตรวจ ให้หลุดออกไป แต่ดีเอ็นเอไม่ได้หลุดออกไปด้วย หลังจากนั้น ก็ล้างด้วย TE buffer ซึ่งมี pH เป็นด่าง ในสภาพที่เป็นด่าง silanol group จะถูกปรับให้มีประจุเป็นลบ ดังนั้น มันก็จะผลักดีเอ็นเอให้หลุดออกจากกระดาษ FTA ซึ่งเป็นการกำจัดดีเอ็นเอส่วนเกินให้ออกไปจากกระดาษ เหลือดีเอ็นเอส่วนน้อยที่ยังติดอยู่บนกระดาษ FTA ซึ่งดีเอ็นเอส่วนน้อยนี้ มีปริมาณเพียงพอ และพอดีในการทดสอบเพิ่มปริมาณดีเอ็นเอด้วยวิธี PCR
ถ้าอย่างนั้น ถ้าเราตัดกระดาษ FTA แล้วมาเติม 5% Chelex solution แล้วนำไปต้ม เราก็จะได้ ดีเอ็นเอ ปริมาณมาก และติดสาร inhibitor ออกมาด้วย (Case นี้ มีสาร inhibitor อยู่ในตัวอย่าง) เพราะฉะนั้น เมื่อทำตามขั้นตอนที่ว่านี้ ผมสกัดดีเอ็นเอ แล้วนำไปวัดด้วยวิธี spectrophotometer วัดปริมาณ ดีเอ็นเอได้ 105 ng/ul หลังจากที่เจือจางดีเอ็นเอให้เหมาะกับการทำ PCR แล้วนำไปทดสอบ ปรากฎว่า สามารถเพิ่มปริมาณดีเอ็นเอได้ แต่ได้ไม่ดีนัก ดูจากความสูงของ peak ค่อนข้างต่ำ และบางตำแหน่ง มีค่าความสูงของ peak น้อยกว่า threshold ที่กำหนดไว้ ดังภาพข้างล่างนี้ครับ

แสดงว่า แม้ว่าจะมีดีเอ็นเอปริมาณที่เหมาะสมแล้ว ก็ยังติดสาร inhibitor อยู่ในตัวอย่างด้วย จึงทำให้การเพิ่มปริมาณดีเอ็นเอทำได้ไม่มีประสิทธิภาพ
ถ้าอย่างนั้น ผมตัดกระดาษ FTA ชิ้นใหญ่ขึ้นมาหน่อย (0.5x0.5 cm) แล้วนำไปล้างด้วย FTA reagent และ TE buffer ตามขั้นตอนปกติ หลังจากนั้น ผมเติม 5% Chelex solution นำไปต้มที่ 100 C นาน 8 นาที นำน้ำใสที่ได้ ไปวัดปริมาณดีเอ็นเอด้วย spectrophotometer ได้ปริมาณดีเอ็นเอ 7.6 ng/ul เจือจางดีเอ็นเอที่ได้นี้ให้เหมาะสม แล้วนำไปทำ PCR ครับ ได้ผลดังภาพข้างล่างนี้

นั่นหมายความว่ากระดาษ FTA ที่ผ่านการล้างด้วย FTA reagent และ TE buffer ช่วยกำจัด PCR inhibitor ส่วนใหญ่ออกไปได้แล้ว และเหลือติด PCR inhibitor บางส่วนติดแน่นอยู่บนกระดาษ FTA ในขั้นตอนนี้ ถ้าเอากระดาษ FTA ไปทำ PCR จะไม่สามารถเพิ่มปริมาณดีเอ็นเอได้ เนื่องจากมี PCR inhibitor ติดแน่นอยู่บนกระดาษ แต่ถ้านำกระดาษ FTA ที่ผ่านการล้างแล้ว มาเติม chelex solution แล้วนำไปต้ม DNA บนกระดาษที่มีปริมาณไม่มากนักนั้น ก็จะหลุดออกมาอยู่ใน chelex solution และมีปริมาณมากเพียงพอที่จะนำไปทำ PCR ได้ ขณะที่สาร PCR inhibitor ที่ติดแน่นอยู่บนกระดาษ ไม่ได้หลุดออกมาใน chelex solution หรืออาจจะหลุดออกมาบ้าง แต่มีปริมาณไม่มากเพียงพอที่จะยับยั้งการทำ PCR ได้
ผม confirm อีกวิธี ถ้าอย่างนั้น ผมก็ตัดกระดาษ FTA แล้วนำมาสกัดด้วยวิธี Qiagen ก็น่าจะกำจัด PCR inhibitor ออกไปได้เช่นกัน เมื่อนำมาทำ PCR ปรากฎว่า ได้ผลดังภาพข้างล่างนี้ครับ

ถ้าจะให้สรุป ตัวอย่างตรวจรายนี้ ซึ่งเป็น buccal cell เก็บบนกระดาษ FTA paper น่าจะมีสาร PCR inhibitor ติดอยู่ในตัวอย่างด้วย ทำให้ไม่สามารถเพิ่มปริมาณดีเอ็นเอโดยตรงจากกระดาษ FTA ได้ ดังนั้น จึงต้องใช้วิธีการสกัดดีเอ็นเอออกจากกระดาษ FTA และกำจัดสาร PCR inhibitor ออกไปก่อน จึงสามารถนำมาเพิ่มปริมาณดีเอ็นเอได้
เมื่อไหร่ที่ทำ PCR โดยตรงจากกระดาษ FTA แล้วไม่ขึ้น ลองตัดกระดาษ FTA ให้ใหญ่ขึ้น แล้วนำไปสกัดด้วย Qiagen หรือ นำมาล้างด้วย FTA reagent และ TE buffer ตามขึ้นตอนปกติ จากนั้น นำไปสกัดด้วย 5% Chelex solution สิครับ บางทีอาจช่วยแก้ปัญหานี้ได้
ความเห็น (2)
เป็นนักสืบสนุกสนานเลยนะคะนี่ สุดยอด
แบบว่า ชมดอกไม้ริมทางน่ะพี่โอ๋ ในเมื่อต้องทำอยู่แล้ว ก็ลองหาเหตุผลดูว่าเกิดอะไรขึ้น แล้วก็ลองเล่นไปเรื่อยๆ เสร็จแล้วก็มาเล่าสู่กันฟัง เวลาที่ใครเจอปัญหาคล้ายๆกัน จะได้มีแนวทางในการจัดการได้ดีและเร็วยิ่งขึ้น ไม่ต้องเสียเวลามาลองผิดลองถูกใหม่