แบบจำลองของอะตอม
แบบจำลองอะตอมของโบร์
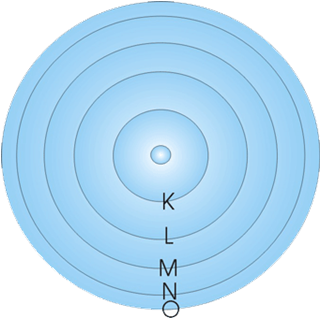
 นัก วิทยาศาสตร์ได้พยายามศึกษาเรื่องเกี่ยวกับอะตอม โดยได้เสนอแบบจำลองอะตอมจากการทดลองที่เกิดขึ้น ซึ่งแบบจำลองของรัทเธอร์ฟอร์ดได้รับการยอมรับแต่ก็ยังไม่สมบูรณ์ จึงมีผู้พยายามหาคำอธิบายเพิ่มเติม โดยในปี 1913 นีล โบร์ (Niels Bohr) นักวิทยาศาสตร์ชาวเดนมาร์ก ได้ทำการศึกษาการเกิดสเปกตรัมของก๊าซไฮโดรเจน และได้สร้างแบบจำลองอะตอมเพื่อใช้อธิบายลักษณะการเคลื่อนที่ของอิเล็กตรอน รอบ ๆ นิวเคลียสเป็นวงคล้ายกับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ แต่ละวงจะมีระดับพลังงานเฉพาะตัว และเรียกระดับพลังงานของอิเล็กตรอนที่อยู่ใกล้นิวเคลียสที่สุด ซึ่งมีระดับพลังงานต่ำที่สุด เรียกว่า ระดับพลังงาน K และเรียกระดับพลังงานถัดออกมาว่า ระดับพลังงาน L,M,N,… ตามลำดับ
นัก วิทยาศาสตร์ได้พยายามศึกษาเรื่องเกี่ยวกับอะตอม โดยได้เสนอแบบจำลองอะตอมจากการทดลองที่เกิดขึ้น ซึ่งแบบจำลองของรัทเธอร์ฟอร์ดได้รับการยอมรับแต่ก็ยังไม่สมบูรณ์ จึงมีผู้พยายามหาคำอธิบายเพิ่มเติม โดยในปี 1913 นีล โบร์ (Niels Bohr) นักวิทยาศาสตร์ชาวเดนมาร์ก ได้ทำการศึกษาการเกิดสเปกตรัมของก๊าซไฮโดรเจน และได้สร้างแบบจำลองอะตอมเพื่อใช้อธิบายลักษณะการเคลื่อนที่ของอิเล็กตรอน รอบ ๆ นิวเคลียสเป็นวงคล้ายกับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ แต่ละวงจะมีระดับพลังงานเฉพาะตัว และเรียกระดับพลังงานของอิเล็กตรอนที่อยู่ใกล้นิวเคลียสที่สุด ซึ่งมีระดับพลังงานต่ำที่สุด เรียกว่า ระดับพลังงาน K และเรียกระดับพลังงานถัดออกมาว่า ระดับพลังงาน L,M,N,… ตามลำดับ
วิธีทำการทดลอง
เขาศึกษาสเปกตรัมการเปล่งแสงของธาตุ โดยบรรจุแก๊สไฮโดรเจนในหลอดปล่อยประจุ จากนั้นให้พลังงานเข้าไป
สเปกตรัม หมายถึง อนุกรมของแถบสีหรือเส้นที่ได้จากการผ่านพลังงานรังสีเข้าไปในสเปกโตรสโคป ซึ่งทำให้พลังงานรังสีแยกออกเป็นแถบหรือเป็นเส้น ที่มีความยาวคลื่นต่างๆเรียงลำดับกันไป
ผลการทดลอง
อิเล็กตรอนเคลื่อนจากขั้วบวกไปขั้วลบชนกับแก๊สไฮโดรเจน จากนั้นเปล่งแสงออกมาผ่านปริซึมทำให้เราเห็นเป็นเส้นสเปกตรัมสีต่าง ๆ ตกบนฉากรับภาพ
สรุปผลการทดลอง
การเปล่งแสงของธาตุไฮโดรเจน เกิดจากอิเล็กตรอนเปลี่ยนระดับพลังงานจากวงโคจรสูงไปสู่วงโคจรต่ำ พร้อมทั้งคายพลังงานในรูปแสงสีต่าง ๆ
ระดับพลังงานแต่ละชั้น
เมื่อ 2.18 X 10-18 J = ค่าคงที่ของริดเบิร์ก(Rydberg constant)
n = เลขควอนตัมหลัก = 1, 2, 3
นีลส์ โบร์ ได้เสนอแบบจำลองอะตอมขึ้นมา สรุปได้ดังนี้
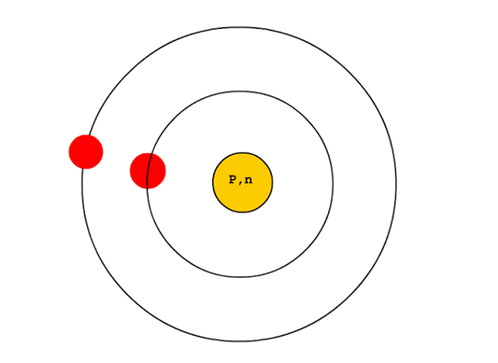
1. อิเลคตรอนจะอยู่กันเป็นชั้น ๆ แต่ละชั้นเรียกว่า “ระดับพลังงาน”
2. แต่ละระดับพลังงานจะมีอิเลคตรอนบรรจุได้ดังนี้
จำนวนอิเลคตรอน = 2n2
ระดับพลังงาน K
ระดับพลังงาน L
ระดับพลังงาน M
ระดับพลังงาน N
ระดับพลังงาน O
ระดับพลังงาน P
ระดับพลังงาน Q
3. อิเลคตรอนที่อยู่ในระดับพลังงานวงนอกสุดเรียกว่า เวเลนซ์อิเลคตรอน (Valent electron) จะเป็นอิเลคตรอนที่เกิดปฏิกิริยาต่าง ๆ ได้
4. อิเลคตรอนที่อยู่ในระดับพลังงานวงในอยู่ใกล้นิวเคลียส จะเสถียรมาก เพราะประจุบวกจากนิวเคลียสดึงดูดไว้อย่างดี ส่วนอิเลคตรอนระดับพลังงานวงนอก จะไม่เสถียร เพราะนิวเคลียสส่งแรงไปดึงดูดได้น้อยมาก อิเลคตรอนพวกนี้จึงมีพลังงานสูงหลุดออกจากอะตอมได้ง่าย
5. ระดับการพลังงานวงในจะอยู่ห่างกันมาก ส่วนระดับพลังงานวงนอกจะอยู่ชิดกันมาก
6. การเปลี่ยนระดับพลังงานของอิเลคตรอน ไม่จำเป็นต้องเปลี่ยนในระดับถัดกัน อาจเปลี่ยน ข้ามระดับพลังงานกันก็ได้
แบบจำลองอะตอมของนิลส์ โบร์
เลือกตัวเลือกนี้ หากข่าวประชาสัมพันธ์นี้เป็นข่าวกิจกรรม
สถานที่: บ้าน
ความเห็น (1)
การเรียรู้ในสิ่งที่ใกล้ตัวที่สุด กับสิ่งที่ไกลตัวที่สุด เป็นเรื่องที่มนุษย์เราต้องทำความเข้าใจให้ดีพร้อมก่อนศึกษาเรื่องรอบๆตัว เพราะเป็นสิ่งที่สำคัญในการต่อยอดองค์ความรู้จริงๆครับผม
ขอบพระคุณในการแบ่งปันองค์ความรู้ที่ดีนะครับ